
L’Ue sta favorendo fortemente lo sviluppo di alternative all’uso dei pesticidi come uno degli obiettivi principali della strategia Farm to Fork (Commissione europea, maggio 2020). Inoltre, il Regolamento (Ce) n. 1107/2009 ha preparato un elenco che comprende diversi prodotti abitualmente utilizzati dagli agricoltori per proteggere le colture di base, che devono essere sostituiti con alternative più favorevoli (candidati alla sostituzione - CfS). La disponibilità di colture tolleranti/resistenti rappresenta un modo efficace per ridurre il rischio di malattie delle piante e perdite alimentari, limitando l’uso di pesticidi. Tale obiettivo può essere raggiunto sfruttando un approccio di breeding tradizionale, ma, oltre alla scarsa stabilità e durata di questo tipo di resistenza, non sempre questa soluzione è praticabile a causa della mancanza di geni di resistenza in genotipi presenti in natura e dei tempi lunghi per l’ottenimento di varietà commercializzabili, soprattutto nel caso di specie da frutto.
La realizzazione di specifici programmi di miglioramento genetico che sfruttano approcci biotecnologici, compresa l’applicazione delle Nuove tecniche genetiche (Ngts), rappresenta una strategia più rapida e precisa rispetto alla selezione convenzionale, per garantire una protezione duratura delle colture e un miglioramento della qualità e resa.
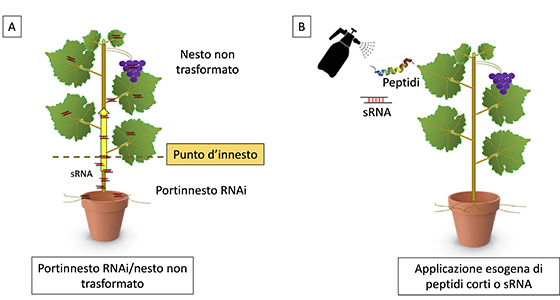
Combinare l’approccio RNAi all’innesto in specie da frutto
La pratica dell’innesto è utilizzata da oltre 2.500 anni e la sua ampia applicazione in ambito agricolo, nella produzione sia di colture annuali che perenni, mira principalmente alla propagazione clonale di marze con difficoltà di radicamento, all’aumento della resa, alla riduzione delle dimensioni di alcuni alberi da frutto, alla modifica dell’architettura del nesto e al miglioramento della tolleranza a stress biotici e abiotici della marza innestata.
Recentemente, l’innesto si è rivelato uno strumento utile anche nella ricerca di base per studiare il movimento di proteine, ormoni e molecole di RNA. Diversi studi in piante innestate dimostrano che un gran numero di molecole di RNA sono mobili e che spesso influenzano vari processi della pianta, come alcune transizioni tra diverse fasi di sviluppo, risposte morfologiche, l’acquisizione di nutrienti e interazioni biotiche. Tra questi scambi di molecole, il movimento di piccole molecole di RNA (sRNA) all’interno di un sistema di innesto è stato recentemente utilizzato come strategia per mirare al silenziamento di specifici geni, attraverso il meccanismo dell’RNA interferente (RNAi), e per controllare vari processi fisiologici legati allo sviluppo delle piante e alle risposte allo stress.
L’RNAi è un meccanismo evolutivamente conservato utilizzato dagli eucarioti per regolare l’espressione di geni endogeni e funziona in pianta anche come meccanismo di difesa contro i patogeni. Esso è stato sfruttato con successo, tramite approcci biotecnologici, per conferire protezione in pianta a vari patogeni e insetti e per migliorare tratti di interesse agronomico. L’RNAi è attivato da molecole di RNA a doppio filamento (dsRNA) che, attraverso specifici complessi proteici, vengono processate in molecole più piccole, gli sRNA, sfruttate per guidare il silenziamento di geni in modo sequenza specifico. Il segnale di silenziamento può spostarsi tra cellula e cellula o percorrere lunghe distanze all’interno della pianta, partendo dal sito di sintesi. Il movimento a corto raggio degli sRNA tra le cellule avviene attraverso i plasmodesmi, mentre il movimento a lunga distanza avviene attraverso il sistema vascolare.
Le molecole di dsRNA possono essere espresse stabilmente nella pianta (silenziamento genico indotto nell’ospite, Higs) attraverso strategie di ingegneria genetica. Tale sistema può portare alla produzione in pianta di sRNA disegnati per avere come target geni vitali di uno specifico patogeno bersaglio. La strategia Higs può essere sfruttata per produrre portinnesti in grado di esprimere stabilmente molecole di dsRNA che, una volta processate dalla cellula vegetale, possono essere trasferite nelle cultivar innestate, senza che polline, semi e frutti siano modificati geneticamente.
Tale strategia è stata applicata inizialmente in specie erbacee e negli ultimi anni anche in specie da frutto, rendendosi utile per indurre resistenza a stress abiotici, come la maggior tolleranza a siccità in melo e a stress biotici come in Zhao e Song (2014), che dimostrarono una maggior tolleranza al virus Pnrsv in nesto di ciliegio non trasformato quando innestato su portinnesto Higs. In maniera simile, portinnesti di arancio dolce e di susino sono stati trasformati per indurre resistenza nel nesto al virus CPV e al virus PPV, rispettivamente.
Applicazione esogena di piccole molecole per la resistenza a patogeni
Nell’ultimo decennio molti studi hanno dimostrato l’esistenza di un meccanismo di comunicazione basato sul traffico di sRNA tramite lo scambio di vescicole extracellulari (Ev) tra patogeni fungini e le loro rispettive piante ospiti, chiamato “cross-kingdom RNAi”. Questo meccanismo sembra modulare l’immunità dell’ospite e la virulenza dei patogeni durante i processi di infezione. Recentemente, questa scoperta ha portato allo sviluppo di una strategia per la gestione delle malattie delle colture basata sull’applicazione esogena, solitamente mediante spray di sRNA o dsRNA sulle superfici delle piante (silenziamento genico indotto da spray, Sigs).
Tale strategia è stata sfruttata per produrre prodotti basati sull’RNAi aventi come target sequenze specifiche di geni vitali, di virulenza, sviluppo o riproduzione di diversi patogeni e insetti, e aumentare il controllo delle malattie da questi causati su molte specie vegetali.
Oltre alla strategia Sigs, basata sull’applicazione esogena di sRNA, un altro approccio innovativo e utile anche per combattere patogeni come batteri e fitoplasmi verso cui l’RNAi non risulta efficace, è quello basato sull’applicazione esogena di peptidi antimicrobici. Sono molecole corte, estremamente semplici, prodotte in natura da un’ampia varietà di organismi come componenti essenziali della loro risposta immunitaria innata. La loro applicazione esogena su pianta ha mostrato efficacia in diversi sistemi fitopatologici. In aggiunta ai peptidi antimicrobici di origine naturale, è possibile produrre peptidi di sintesi con attività antimicrobica altamente specifica, selezionati sulla base della loro affinità e specificità per le proteine bersaglio vitali di determinati patogeni.
Sia gli sRNA che i corti peptidi sono considerati agenti altamente specifici, di veloce degradazione, efficaci a basse dosi, caratteristiche che li rendono adatti all’uso in sistemi di agricoltura sostenibile anche quando applicati in modo esogeno sui tessuti della pianta. Negli ultimi anni, le nanotecnologie hanno fornito diversi modi per aumentare l’efficacia del rilascio di dsRNA e peptidi corti sui tessuti della pianta, aumentarne l’assorbimento da parte del patogeno target e renderli più stabili alle avversità ambientali tramite l’uso di specifici formulati. Tali caratteristiche rendono queste molecole adatte per creare biopesticidi innovativi, altamente efficienti e sostenibili.

Studi in specie da frutto applicando metodi biotecnologici
Diversi progetti e convenzioni di ricerca svolti dal nostro gruppo stanno sfruttando l’approccio RNAi stabile sia in varietà sia in portinnesti di specie da frutto per indurre resistenza a malattie virali e fungine in nesti non trasformati. In particolare, grazie al sostegno del Consorzio fitosanitario provinciale di Modena e del Consorzio italiano vivaisti viticoli Ampelos, sono in corso studi per indurre maggior tolleranza a Botrytis cinerea e a Plasmopara viticola in varietà di vite innestate su portinnesti RNAi. Lo stesso approccio sarà sfruttato per contrastare una delle emergenze fitosanitarie che stanno colpendo la vite, Il giallume fitoplasmatico della Flavescenza Dorata (Fd), causata dal fitoplasma Flavescence dorée phytoplasma (FD phytoplasma), trasmesso in pianta tramite l’insetto vettore Scaphoideus titanus. Due strategie parallele saranno sfruttate per contrastare tale malattia, una che mira a limitare la diffusione del vettore tramite espressione in pianta di sequenze di dsRNA specifiche per il controllo dello Scaphoideus titanus e, l’altro, che sfrutta sia l’espressione endogena che l’applicazione esogena di corti peptidi antimicrobici con target il fitoplasma responsabile del giallume.

All’interno del progetto nazionale Pon Reso - REsilienza e SOstenibilità delle filiere ortofrutticole e cerealicole per valorizzare i territori, coordinato da Bartolomeo Dichio dell’Università della Basilicata, l’approccio RNAi viene sfruttato invece per indurre maggior tolleranza al virus PPV, causa della sharka nelle drupacee, in varietà di pesco non trasformate innestate su portinnesti RNAi di albicocco e susino resistenti al virus PPV. Nello stesso progetto, sono state prodotte piante di fragola ottoploide con espressione stabile di molecole di dsRNA avente come target geni vitali di Drosophila suzukii, i cui frutti sono in corso di analisi per verificare una loro maggior resistenza all’insetto. Infine, tra i vari obiettivi di ricerca del progetto nazionale Prin Krer - “Cross-Kingdom RNAi for enhancing plant resistance”, si valuterà l’espressione stabile in varietà e portinnesti di pero di dsRNA contro il fungo Stemphylium vesicarium, per aumentare la tolleranza a tale fungo, causa della maculatura bruna del pero. Tale studio offre la possibilità di identificare strategie utili a limitare una nuova grave emergenza fitosanitaria evidenziata da molte imprese private del settore della pericoltura del territorio nazionale, che a loro volta contribuiscono allo sviluppo di questo progetto.
I vari studi sopra descritti hanno il fine di contribuire allo sviluppo di possibili soluzioni innovative per il controllo di molteplici emergenze fitosanitarie che stanno colpendo diverse specie da frutto importanti nel panorama agricolo del nostro Paese. L’auspicio è che tali strategie possano in futuro integrarsi in sistemi di controllo già in atto, spesso non sufficientemente efficaci a contenere tali criticità, con il fine ultimo di ridurre l’uso ingente di trattamenti a base di pesticidi di sintesi dannosi per l’ambiente e per l’uomo.
Bibliografia disponibile in redazione









